各国展开新冠疫苗研发竞赛,我国五条技术路线正在同步推进。这五大路线如何理解?应用了哪些转基因技术?最快何时应用?
撰文 | 陶黎纳
3月11日,世界卫生组织宣布,2019冠状病毒已经构成全球性大流行。
3月18日,著名游戏《瘟疫公司》里最难被感染、只要被感染玩家就基本获胜的格陵兰岛,也沦陷了。
▲ 游戏《瘟疫公司》截屏,白色的是未感染的格陵兰岛
3月27日,美国累计确诊病例8.5万,超过中国的8.2万,成为世界第一。
截止3月底,全球共有超过200多个国家/地区出现疫情,有人的地方就有病毒。
毫无疑问,人类已经面临百年来最大的一场瘟疫。
就像很多瘟疫灾难片,最后的希望是某种神奇的解药。现实世界里,这种神奇的解药只可能是疫苗,但疫苗通常没那么快研发出来。
和平年代,一种疫苗从开始研发到最终上市,至少需要5~10年时间。现在不是和平年代,现在是全人类与病毒短兵相接的大战时刻,对疫苗的需求比以往任何时候都迫切。好在当前的疫苗技术也是今非昔比,完全有可能在保证安全和有效的前提下,用最快的速度研发出可供大规模人群使用的疫苗。
最快的疫苗研发速度有多快?
2月11日,世界卫生组织总干事谭德赛说疫苗需要18个月,3月27日他再次表态说疫苗需要12~18个月。远水解不了近渴,等疫苗研发出来,全人类都可能已经感染过病毒,灾难已然发生,疫苗恐怕只能保护新生儿了。

2月21日,在国务院疫情联防联控机举行的发布会上,国家卫健委宣布:
我国目前有5条疫苗研发技术路线在同步开展,分别是灭活疫苗,重组基因工程疫苗,腺病毒载体疫苗,流感病毒载体疫苗,核酸疫苗。估计最快在今年4月份可以有部分的疫苗进入临床试验。
本来,疫苗在4月份进入人体临床试验已经是非常快的速度了。实际速度更快,我们的腺病毒载体疫苗于3月16日就开始人体临床试验,与美国的mRNA疫苗人体临床试验几乎同时进行。
然而疫苗还需要再快,笔者认为:我国的2019冠病疫苗最快可能在6月底前大规模人群使用,但这不算常规意义上的上市。
为何有这样的判断?让我们来了解一下2019冠病疫苗研发的若干种技术。
下面把我国现役疫苗使用的技术和此次2019冠病疫苗研发使用的技术整合在一起介绍,读者即可了解疫苗研发技术的全貌,又可以把握2019冠病疫苗研发的技术水平与成功可能性。我把疫苗的三个关键参数进行量化评估,分别是安全性、有效性和量产性,满分为五颗★。
01
活疫苗
安全性:★★★
有效性:★★★★★
量产性:★★★
发明于1798年的预防天花的牛痘疫苗,是第一种人类公认的疫苗,这是一种活疫苗,含有活的牛痘病毒。人类通过接种牛痘疫苗以及改良后的天花疫苗,于1980年消灭了天花。现在,人类已经不需要接种牛痘/天花疫苗了,不过活疫苗技术还在广泛使用。
现役疫苗中活疫苗有:卡介苗(预防结核病)、脊灰活疫苗、麻腮风疫苗(包括麻疹、腮腺炎和风疹疫苗的排列组合)、乙脑活疫苗、甲肝活疫苗、水痘疫苗、轮状病毒疫苗、黄热病疫苗、炭疽疫苗、鼠疫疫苗、布病疫苗。
上面这些疫苗名称中,有些没有用【活疫苗】,是因为该疫苗目前只有活疫苗,无需特别说明。疫苗名称里提到【活疫苗】的,表示该疫苗还有未使用活疫苗技术生产者。
活疫苗里含有活病原体,通常可以引起人体轻微/隐性感染。这种感染模拟了自然感染,所以活疫苗的预防效果通常优于非活疫苗。但是,活疫苗的缺点也比较明显。
首先,要得到不引起人体严重感染的病原体并不容易,通常要经过长期培养和不断试验才能偶得,这次2019冠病疫苗研发路线里没有活疫苗技术,关键就是时间上不允许。
其次,不同活疫苗里病原体的致病能力各不相同,总体来说安全性不如非活疫苗。有些活疫苗的安全性很好,比如乙脑活疫苗和甲肝活疫苗,没有引发有症状感染的报告。有些则会引起明显的感染,比如90%的卡介苗接种者会有局部溃疡,还有1‰的卡介苗淋巴结炎;脊灰活疫苗有几十万分之一的概率会导致肢体永久性瘫痪。麻腮风疫苗和水痘疫苗则可以引起轻症感染,但并不严重。
活疫苗需要培养病原体,还需要提纯,再加入稳定剂等,产量一般,并不适合紧急情况下的大量供应。
02
灭活疫苗
安全性:★★★★
有效性:★★★★
量产性:★★★
活疫苗之后的技术就是灭活疫苗,相对于活疫苗来说安全性更好,肯定不会导致人体感染。由于不能模拟自然感染,其效果略逊于活疫苗,但可以通过增加剂量和接种剂次的策略弥补。
现役疫苗中灭活疫苗有:脊灰灭活疫苗、乙脑灭活疫苗、甲肝灭活疫苗、狂犬病疫苗、手足口疫苗、霍乱疫苗、钩体疫苗、出血热疫苗、森脑疫苗。
上面这些疫苗名称中,有些没有用【灭活疫苗】,也是因为该目前疫苗只有灭活疫苗,无需特别说明。
灭活疫苗虽然不像活疫苗那样需要担心感染导致严重不良反应,但灭活疫苗工艺过于简单粗暴,是把病原体整个杀灭后直接做成疫苗,疫苗关键成分就是整个灭活的病原体。然而灭活的病原体太大了,成分过于复杂,真正能让身体产生免疫力的,其实只是其中一小部分,其余部分非但没用,还会增加不良反应。
以流感疫苗为例,最初的流感疫苗叫做全病毒疫苗,就是含有整个灭活的流感病毒,然而因为不良反应太大而被淘汰了。目前最常用的流感疫苗叫做裂解疫苗,可以理解为把流感病毒大卸八块后的碎片做成疫苗,效果还不错,不良反应也小多了。还有一种流感疫苗叫做亚单位疫苗,可以理解为病毒碎片的碎片,不良反应更小了,但效果似乎也差了一点,所以并不主流。
总体而言,灭活疫苗不需要找到病原体上那个关键的、可以产生免疫力的组分,所以容易实现。如果不良反应不是太大,这不失为一种简单而低成本的疫苗技术。另外,如果病原体引发人体免疫的关键成分难以确定,也只能采用灭活疫苗技术了。
这次2019冠病疫苗技术路线之一就是灭活疫苗,这其实是5条技术路线中最落伍的一条。在疫苗不良反应不明确的情况下采取这种技术,只是为了提高成功的保险系数。因为其他4条技术路线都针对2019冠状病毒的S蛋白,万一失败呢?这种情况下,灭活疫苗或许还有成功的机会。
灭活疫苗也需要培养病原体,还需要提纯,再加入稳定剂等,产量一般,而且由于效果略逊,所以需要的剂量通常要大于同种活疫苗。比如,脊灰灭活疫苗需要的病毒量大约是活疫苗的100倍。如果2019冠病疫苗的灭活疫苗和基于S蛋白的疫苗都成功了,那么灭活疫苗在产能和安全性上也很可能处于明显劣势,当超级替补的可能性很大。
03
组分疫苗
除了活疫苗和灭活疫苗,其他疫苗都是组分疫苗,只是技术实现方式不同,可以再细分为常规组分疫苗和转基因组分疫苗,后者还可以再细分为体外表达和体内表达。2019冠病疫苗的其他4条技术路线,都属于转基因组分疫苗,但技术各不相同。
组分疫苗不是活疫苗,因为没有活病原体;组分疫苗也不算灭活疫苗,因为不含完整的病原体全尸。组分疫苗只是把病原体上那个关键的、可以产生免疫力的组分做成疫苗。从逻辑上来说,灭活疫苗和组分疫苗可以称为非活疫苗,与活疫苗对应。
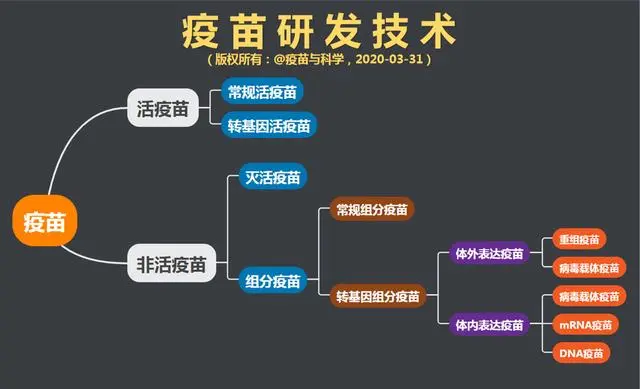
上图涵盖了目前所有的疫苗研发技术,可以看到转基因技术已在疫苗领域被广泛应用。在食品领域,很多人谈转基因色变,然而在医药领域转基因已经是一种不可或缺的技术。目前,所有合法上市的转基因食品或药品都非常安全,建议大家不要相信网上各种转基因谣言。
前面已经介绍了活疫苗和灭活疫苗,下面介绍最重要的组分疫苗技术。
▍常规组分疫苗
安全性:★★★★★
有效性:★★★★
量产性:★★★
现役疫苗中常规组分疫苗有:白百破疫苗(包括白喉、百日咳和破伤风疫苗的排列组合)、流感嗜血杆菌疫苗、流脑疫苗、肺炎球菌疫苗、伤寒疫苗。
白百破疫苗里的白喉和破伤风成分都是类毒素蛋白;百日咳成分是百日咳毒素、丝状血凝素等;流感嗜血杆菌疫苗就是荚膜多糖与蛋白的结合物;流脑疫苗和肺炎球菌疫苗有多糖疫苗和多糖与蛋白结合的结合疫苗;伤寒疫苗目前只有多糖疫苗。
不同的组分疫苗选择的病原体关键成分各不相同,但其作用机制主要有两类,一类是中和毒素(白喉和破伤风),另一类是阻止病原体与人体细胞结合。
除了灭活疫苗,全球所有2019冠病疫苗都是针对病毒表面的突触蛋白(S蛋白) 。S蛋白被认为是2019冠状病毒表面与人体细胞上ACE2受体结合的关键成分,所以组分S蛋白疫苗的机制就是让抗体与S蛋白结合,使其丧失与人体细胞结合的能力,病毒无法进入细胞就不能感染人体了。
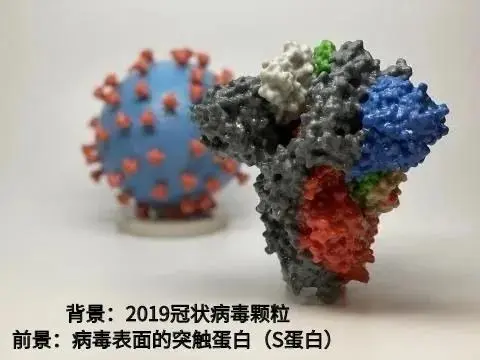
常规组分疫苗也需要培养病原体,还需要提取出病原体上的疫苗关键成分。有时候,这种关键成分还需要加入佐剂或进行加工处理,才能取得较好的预防效果。常规组分疫苗产量不高,但好在成分比较精确,安全性明显优于灭活疫苗。
2019冠病疫苗技术路线中没有常规组分疫苗,也并不意外。常规组分S蛋白疫苗需要培养病毒后,再从病毒颗粒上提取S蛋白,这个提取工艺并非现成,还需要研究,提取过程还会有损耗导致S蛋白产量不高,这样折腾还不如直接把病毒灭活做成疫苗。
转基因组分S蛋白疫苗则是另一番景象。
▍体外表达疫苗-重组疫苗
安全性:★★★★★
有效性:★★★★
量产性:★★★★
现役疫苗中重组疫苗有:乙肝疫苗、戊肝疫苗、宫颈癌疫苗。
转基因技术分为体外表达和体内表达两种。体外表达技术指在人体外合成疫苗关键成分,体内表达就是在人体内合成疫苗关键成分。
体外表达技术在乙肝疫苗、宫颈癌疫苗和戊肝疫苗上使用的历史有30年、14年和8年。乙肝疫苗的关键成分是乙肝表面抗原。历史上,最早的乙肝疫苗需要从乙肝携带者血液中提取乙肝表面抗原,产量不高且有潜在的安全风险,现在已经全都是转基因疫苗,产量高,质量好,竞争激烈,已然白菜价,我国政府采购给婴幼儿免费接种的乙肝疫苗价格只有3.1元/支。
体外表达技术在疫苗领域已经非常成熟,所以2019冠病疫苗技术路线第2条就是【重组基因工程疫苗】,这很容易理解。这种技术是把编码疫苗成分的基因转到特定微生物,后者很容易大量培养,顺便就把疫苗成分批量生产出来了,提纯一下就是疫苗了。
乙肝疫苗的转基因技术用到了3种微生物,分别是酿酒酵母、汉逊酵母和CHO细胞。酿酒酵母有时也称啤酒酵母,对!就是生产啤酒发酵用的酵母。

戊肝疫苗的转基因技术用大肠杆菌,宫颈癌疫苗则用了酿酒酵母、大肠杆菌和昆虫粉纹夜蛾的细胞。
目前,天津大学生命科学学院黄金海团队已经用酿酒酵母生产出组分S蛋白疫苗,还有重庆智飞旗下的龙科马公司用CHO细胞生产出了组分S蛋白疫苗,预计4月份开展人体临床试验。
酿酒酵母和CHO细胞的组分S蛋白疫苗获得初步成功,这意味着,我国其他具备这些技术的疫苗企业(深圳康泰、华兰生物、北京天坛、大连汉信、华北金坦),都有可能略作调整就能大批量生产组分S蛋白疫苗,成为我国2019冠病疫苗供应的最大保障。
▍体外表达疫苗-病毒载体疫苗
安全性:★★★★★
有效性:★★★★★
量产性:★★★★
现役疫苗中尚未应用这种技术。
然而,卫健委提到的5条技术路线有1条就是流感病毒载体疫苗,并解释其机制是:
用减毒的流感病毒疫苗作为载体,我们已经有批准上市的减毒的流感病毒疫苗,在这个流感病毒上面,增加一个新冠病毒的蛋白。
减毒的流感疫苗就是流感活疫苗,采用喷鼻方式接种,其中含有适应低温的流感活病毒。这种活病毒在低于37度的上呼吸道内能有限复制但不致病,在37度的肺内则无法复制。从理论上说,这种流感活疫苗可以模拟自然感染,产生较为全面的免疫力,效果略优于流感裂解疫苗或亚单位疫苗,但还需实践检验。
我国内地目前有一种批准上市的喷鼻剂型流感活疫苗,香港大学也有一款同类疫苗。根据笔者了解,卫健委提及作载体的流感活疫苗,应该是指香港大学的疫苗。
2019冠病疫苗的流感病毒载体技术,应该是把S蛋白基因转入载体流感病毒的基因内,让载体流感病毒表面长出S蛋白,人体对这种流感病毒产生免疫力的同时,也能对2019冠状病毒免疫,可谓一箭双雕。
由于通过流感活病毒模拟感染来预防2019冠状病毒,每剂疫苗需要的流感活病毒量不会太大,相当于提高了疫苗的产能。
不过这种技术还未有人用疫苗上市经验,研发和生产过程中会遇到怎样的问题上无法估计,时间上存在很大的不确定性。
▍体内表达疫苗-病毒载体疫苗
安全性:★★★★★
有效性:★★★★★
量产性:★★★★
现役疫苗中,非常规使用的埃博拉疫苗已经使用该技术,目前已知的有天津康希诺、美国默沙东、美国强生的埃博拉疫苗均使用了腺病毒载体技术。默沙东的埃博拉疫苗已经于2019年底通过了世界卫生组织的预认证。
这也是卫健委提到的5条技术路线,而且是我国最早(3月17日)上人体临床试验的2019冠病疫苗。据志愿者们透露,陈薇院士团队的11人,早在2月29日就已经接种该疫苗。
腺病毒载体技术也把S蛋白基因转入载体腺病毒的基因内,但与流感病毒载体疫苗不同的是,腺病毒表面不会长出S蛋白。接种该疫苗后,腺病毒载体会进入细胞,由于基因缺陷,腺病毒本身无法复制,但其基因内的S蛋白基因会启动产生S蛋白,这种S蛋白会从细胞内转移到细胞外,这个过程也类似感染过程,所以也能产生良好的免疫效果。
腺病毒载体技术相当于把人体细胞当作了疫苗工厂,大大简化了疫苗生产过程。无法自我复制的腺病毒会被人体免疫机制清理掉,安全性非常好,人体内S蛋白的生产过程可以维持1~2周,持续刺激人体产生免疫力。
腺病毒载体2019冠病疫苗的人体试验只安排了1剂,美国同时开展的mRNA疫苗,则需要间隔1个月接种2剂。就笔者目前掌握的信息,其他技术路线的2019冠病疫苗估计都至少需要2剂。所以,腺病毒载体疫苗在节约疫苗、节约医疗资源、减少受种者就医成本方面具有明显优势。
腺病毒载体疫苗可以利用人体工厂产生S蛋白,所以每剂疫苗需要的病毒量不太大,目前试验用剂量是500亿~1500亿个腺病毒颗粒,重约50~150微克。假定10微克S蛋白疫苗可以与1000亿个腺病毒的疫苗效果相当,那么这些S蛋白对应的2019冠状病毒量估计是腺病毒量的250倍,可以认为腺病毒载体疫苗的产能优势也很明显。
▍体内表达疫苗-mRNA疫苗
安全性:?
有效性:?
量产性:★★★★★
DNA和mRNA都是核酸,基于这两种技术的疫苗都是核酸疫苗。
核酸是生命的遗传物质,核酸里带有编码生命各种成分信息的那部分又被叫做基因,基因可以理解为生命的图纸。DNA是原始图纸,mRNA是从复制版图纸,图纸可以生产出各种蛋白质,实现生命的各种功能。
mRNA前的m是message的意思,通常被称为信使RNA。mRNA的功能是将DNA的编码信息从细胞核中复制出来,然后与另外两种RNA一起合成蛋白质。
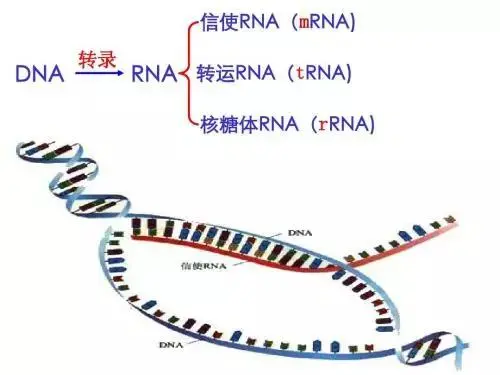
腺病毒载体疫苗需要把疫苗图纸通过载体带入人体细胞,mRNA疫苗则简单粗暴,直接把疫苗图纸注入人体,让人体细胞用这段外来图纸合成疫苗成分。
核酸疫苗相比非核酸疫苗,有一个突出优势,就是可复制,产量惊人。非核酸疫苗,无论是活疫苗还是灭活疫苗还是组分疫苗,其成分是多糖或蛋白质或者病原体,都无法直接复制,必须有一个培养和提取的过程。
核酸疫苗的生产过程也可能是颠覆性的,很可能只需要一个房间就够了。非核酸疫苗则通常需要一个车间、一条流水线去培养微生物、收获蛋白质/多糖、提纯等。
如果mRNA疫苗真的成功了,还有一个碾压传统疫苗的优势。mRNA就是一根链条,可以把预防A病、B病、C病……的链条串在一起,做成一条长链条,这就相当于多联疫苗。接种这种多联mRNA疫苗就可以预防N种疾病,预防接种将变得非常简单高效,那可以说是疫苗革命。
美国最先开展人体试验的2019冠病疫苗,来自mRNA疫苗巨头Modena公司。该公司在过去的四年中开展了9项mRNA疫苗的第1期人体临床试验,有超过1000人接受了该技术的疫苗。
Modena公司的mRNA技术2019冠病疫苗,未开展动物试验即上人体临床试验了,这种极不寻常的做法基于该公司多年的经验积累,实际风险并不大。
国内上海的斯微生物也正在研发mRNA的2019冠病疫苗,但还需要经过动物试验,预计将在4月中旬后开展人体临床试验。
mRNA疫苗最大的缺点是容易降解,Modena公司的核苷修饰技术能极大提高mRNA的稳定性,还能调节mRNA药物在体内的半衰期,不过其2019冠病疫苗仍然需要间隔1个月接种2剂。我国的腺病毒载体疫苗只需接种1剂,比Moderna的疫苗节约1个月。3期人体临床试验下来,我国理论上至少比美国快3个月。
mRNA疫苗前景很美好,但目前全球还没有mRNA疫苗进入第2期人体临床试验,更不要说上市的成熟疫苗了。所以,mRNA技术研发2019冠病疫苗是否一定能成功,还存在较大的不确定性。
▍体内表达疫苗-DNA疫苗
安全性:???
有效性:?
量产性:★★★★★
mRNA是把复制版图纸送入人体,DNA疫苗是把原版图纸送入人体。
但是,与mRNA疫苗不同的是,DNA疫苗需要把DNA送入到细胞核内,再拷贝到mRNA上,之后的疫苗组分生产过程就和mRNA疫苗很相似了。如果这种外来DNA与细胞自己的DNA整合,会有怎样的安全性风险?这是目前最担心的。

1月28日媒体报导,美国Inovio公司与苏州的艾棣维欣生物合作用DNA技术研发2019冠病疫苗,但没有后续消息。
3月8日媒体报导,上海公共卫生临床中心的徐建青团队正在用DNA技术研发的2019冠病疫苗,他本人于2月26日给自己接种了1剂,两周后接种第2剂(这个不能算人体临床试验)。当时该疫苗已完成小鼠动物试验,针对灵长类动物的动物试验正在进行。
mRNA疫苗至少有1000人的第1期人体临床试验经验,但DNA疫苗还没有人体临床试验的报导,其成熟度还不如mRNA疫苗,不应对DNA技术抱太高的期望值。
04
总 结
我国的2019冠病疫苗研发技术路线,除了传统的灭活疫苗,其他都是基于转基因技术的高科技路线。其中,组分疫苗和腺病毒载体疫苗在技术和生产方面最成熟,取得成功的可能性最大。
全球2019冠状病毒疫情进展速度惊人,急需疫苗解围。在这种危急形势下,笔者认为疫苗研发速度还可以加快:
第1期人体临床试验确认安全性和观察抗体可以压缩到1个月左右(到4月中旬);
之后尽快开展数百人对照的第2期人体临床试验,进一步验证安全性和抗体水平,再需要1.5个月左右(到6月初);
完成2期人体临床试验的疫苗,已经具备了相当可靠的安全性和有效性,可以尝试量产,最快6月底前可以准备出上百万支疫苗用于医务人员、警务/边检人员的应急接种。
(声明:本文仅代表作者观点,不代表本站观点,仅做陈列之用)
[责编:tdsr]
郑重声明:本文版权归原作者所有,转载文章仅为传播更多信息之目的,如作者信息标记有误,请第一时间联系我们修改或删除,多谢。



tdsrwz@163.com
